Die antimikrobielle Photodynamische Therapie (aPDT) ist ein nicht-invasives[1], schonendes, medizinisch notwendiges[4] Verfahren, bei dem pathogene Mikroorganismen (Keime) mittels eines Photosensitizers (Farbstoffs) zerstört werden - ohne gesundes Gewebe anzugreifen und ohne systemische Nebeneffekte - bei parodontalen, periimplantären, endodontischen und sonstigen oberflächlichen Entzündungen.
Im Bereich der Parodontitis-Therapie kommt die antimikrobielle Photodynamische Therapie (aPDT) zur Anwendung, wenn keine tiefen Taschen vorliegen und keine Konkremente - wäre dies der Fall, wird empfohlen, die Keime thermisch mit 1 Watt Leistung zu reduzieren, zu "dekontaminieren".
Der Farbstoff lagert sich aufgrund seiner hydrophilen Eigenschaften und protonierten Ladung an die negativen Ladungsträger von Lipopolysacchariden in den Membranen gramnegativer Keime an, sowie an die Peptidoglycane in den Membranen grampositiver Keime. Durch die Laserbestrahlung wird der Farbstoff zur Bildung von Sauerstoffradikalen (Singulett- / Triplett-Sauerstoff) angeregt. Dieser reaktive Sauerstoff schädigt die ungesättigten Fettsäuren in den Bakterienmembranen und deren Organellen und führt so zum Absterben der Keime. Darüber hinaus bewirkt die nicht im Farbstoff absorbierte Laserenergie mit ihrem photobiologischen Effekt eine Heilungsunterstützung - parallel zur Bakterienreduktion.[1],[2],[11]
Seit einigen Jahren wird die aPDT auch in der Zahnheilkunde erfolgreich eingesetzt, insbesondere gelten die beiden Photosensitizer Toluidinblau und Methylenblau als erfolgreich eingeführt[1],[5].
Toluidinblau O (TBO), auch Toloniumchlorid, (3-Amino-7-(dimethylamino)-2-methylphenothiazin-5-ium-chlorid) ist ein blauer Farbstoff zur histologischen und intravitalen Färbung, sowie bei Vergiftungen mit Methämoglobinbildnern als Antidot. In der Zahnheilkunde dient der (gering spezifische) Toluidinblautest der Unterscheidung von gutartigen und präkanzerösen Leukoplakien. Wie auch das Methylenblau wirkt Toluidinblau geringfügig antiseptisch. Die geringe Toxizität macht einen medizinischen Einsatz unproblematisch, insbesondere bei oberflächlicher Anwendung. Die LD50(Ratte), i.p. verabreicht, liegt bei 215 mg·kg-1. Werden größere Mengen Toluidinblau verschluckt, färbt es den Urin grün.[1]
Mit einem Absorptionsmaximum von λmax = 635nm ist es für die Anwendung im Zusammenhang mit roten Lasern ideal geeignet. Verwendet man infrarotes Licht außerhalb dieses Absorptionsmaximums, ist die Absorption entsprechend geringer, so dass ein Teil der Leistung nicht zur Anregung zur Verfügung steht. Für die Wellenlänge 810 nm konnte gezeigt werden, dass die Anregung des Farbstoffs gelingt, indem der Faktor Leistung so angepasst wird, dass die benötigte Energiedichte und -dosis erreicht wird. Die nicht im Farbstoff absorbierende Laserenergie trifft auf das umliegende Gewebe und schafft dort zusätzliche LLLT-Effekte, insbesondere eine Heilungsbeschleunigung.[2],[11]
ORALIA® blue Photosensitizer ist ein Farbstoff auf Toluidinblau-Basis für die antimikrobielle Photodynamische Therapie bei parodontalen, periimplantären, endodontischen und sonstigen oberflächlichen Entzündungen. Die Aktivierung erfolgt mit einem 810nm-Laser (ora-laser d-lux oder seinem Vorgänger ora-laser jet).
Der Farbstoff weist eine besondere, mittlere Viskositätsstufe auf, nicht zu dünnflüssig, nicht zu dickflüssig, so dass er sowohl ein optimiertes Fließverhalten (zum Beispiel in PA-Taschen), als auch optimiertes Haftverhalten (oberflächliche Desinfektion, zum Beispiel bei candida albicans) bietet.
Bereits seit den frühen 1990er Jahren wird intensive Grundlagenforschung über die bakteriziden Effekte der aPDT auf parodontalpathogene Mikroorganismen betrieben. Zweifelsfrei ist, dass der Wirkstoff Toluidinblau ein effektiver Photosensibilisator ist, der sowohl grampositive als auch gramnegative parodontalpathogene Keime inaktivieren kann.[8],[9],[10]
Insgesamt wird die Studienlage auch heute noch oft als "ausbaufähig", manchmal sogar als "ungenügend" beschrieben, jedoch kommt man nicht umhin, dem Verfahren eine gewisse Berechtigung einzuräumen. Die Hauptvorteile des Verfahrens liegen darin, dass es mit keinen bekannten Nebenwirkungen und nur geringen Risiken einhergeht und dass es das Problem der Resistenzen bei der Antibiotikagabe umgeht, darüber hinaus gut zu steuern ist und dass auch schwer zugängliche Bereiche therapiert werden können.[1],[5]
Im Rahmen des Konformitätsbewertungsverfahrens für ORALIA® blue Photosensitizer wurden nicht nur die "Mindestanforderungen" (Nicht-Toxizität und Wirksamkeit) erfolgreich belegt - Wir konnten darüber hinaus im Rahmen einer Studie in 2015 mit Hilfe eines 3D-Zellmigrationstests zeigen, dass auch LLLT-(Softlaser)-Effekte bei der aPDT in Kombination mit dem ora-laser d-lux eintreten. Bei dem Test wurden Fibroblasten in eine Kollagenmatrix eingebettet, "behandelt" und dabei der Einfluss der Behandlung (810nm-Bestrahlung, 810nm-Bestrahlung+aPDT und jeweils eine Kontrollgruppe) auf die Aktivität aufgezeichnet und ausgewertet. Fazit der Studiengruppe: "We conclude that LLLT as photodynamic therapy (PDT) using ora-laser d-lux 810nm promotes proliferation and maturation of human fibroblasts in vitro.", nachzulesen in der Studie [7].
In unserer Pressemitteilung vom 17.08.2014 hatten wir bereits berichtet, dass die "Biostimulation mit Low Level-Lasertherapie im Wellenlängenbereich von 810nm als regenerative Therapie bestätigt" worden ist. Arany et al. hatten in einem standardisierten Tierexperiment nachgewiesen, dass die Low Level-Lasertherapie im 810nm-Bereich einen Wachstumsfaktor (transforming growth factor-ß [TGF-ß]) aktiviert, der zur Generation von reaktivem Sauerstoff und damit zur Differenzierung von ortsständigen dentalen Stammzellen führt. [11]
Damit kann davon ausgegangen werden, dass die antimikrobielle photodynamische Therapie mit Diodenlasern im 810nm-Wellenlängenbereich neben der antibakteriellen Wirkung auch eine regenerative Komponente hat, die über den nunmehr bekannten "pathway", der Stimulation des transforming growth factor-ß (TGF-ß), unmittelbar auf die parodontalen (periimplantären) Stammzellen wirkt.
Nach Auftragen/Einbringen des Farbstoffs und einer kurzen Einwirkzeit wird er mittels 810nm-Laser bestrahlt.
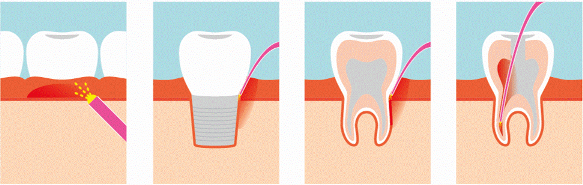
Abb.1: Transgingivale Bestrahlung mittels Glasstab. Abb. 2-4: Interne Bestrahlung mit einer Glasfaser.
Eine der Anwendungsbereiche der aPDT ist die erweiterte Prophylaxe, zur Erhaltung des gesunden, aber reduzierten oder austherapierten Parodonts nach Parodontitis, hier kann sie einen wesentlichen Beitrag leisten[6]. Bei Bedarf klärt die Prophylaxeassistenz selbst auf und führt die Arbeiten nach Therapieentscheidung durch den Zahnarzt aus. Somit wird die Behandlung effizienter.
Informationen zur Abrechnung [analog] finden sich hier. Hinweis: Das Verwaltungsgericht Stuttgart hat die medizinische Notwendigkeit bestätigt - siehe Urteil vom 11.03.2013 (Az. 13 K 4202/11) [4].
ORALIA-Laser-Anwender
Als Anwender des ora-laser d-lux oder ora-laser jet fordern Sie bitte telefonisch, via E-Mail oder Kontaktformular das entsprechende Bestellformular bei uns an.
Anwender anderer Lasergeräte
Bei Verwendung anderer Lasergeräte muss geprüft werden, ob das Gerät alle erforderlichen Bestrahlungsparameter (Leistung, Fläche, Numerische Apertur,...) bietet, dann muss die Konformität für die Anwendung gezeigt werden. Wir führen diese Tests fortschreitend mit Geräten anderer Hersteller durch und beraten Sie gern zur Konformität Ihres Gerätes für diese Anwendung. Bitte kontaktieren Sie uns telefonisch, via E-Mail oder Kontaktformular.
Der Farbstoff ist einem 10ml-Primärbehälter abgefüllt. Von hier aus wir die gewünschte Menge Farbstoff (z.B. etwa 0,4 ml für eine full-mouth Desinfektion) zunächst in einen kleineren Sekundärbehälter umgefüllt, zum Beispiel in eine sterile 0,2ml-Einmalspritze, und dann unter Verwendung einer Standard-Einmalkanüle am Patienten appliziert.
Sterile Einmal-Spritze (Sekundärbehälter)
Wir empfehlen: B.Braun Injekt® Luer Lock, 2ml, einzeln verpackt, steril, Luer-Lock, Hersteller-Art.Nr: 4606701V
Diese Spritzen (100er-Pack) können bei uns direkt mitbestellt werden, siehe Bestellformular.
Sterile Einmalkanüle
Wir empfehlen: Transcodent Spülkanüle Endo 25G 0,5x42mm, einzeln verpackt, steril, Luer-Lock, Hersteller-Art.Nr: 6517
Diese Kanülen (100er-Pack) können bei uns direkt mitbestellt werden, siehe Bestellformular.
ORALIA medical GmbH
Schneckenburgstr. 11
78467 Konstanz
Tel: +49 7531 284030
Email: info@oralia.de
ORALIA wurde 1980 in Konstanz am Bodensee gegründet und ist ein deutsches Medizintechnik-Unternehmen, spezialisiert auf die Entwicklung und Produktion, sowie den Vertrieb und die Wartung medizinischer Lasergeräte.
25.01.2023
Neue Laser-Kurse sind online!
Lernen Sie alles Wesentliche ü...
26.09.2020
Verschoben: ORALIA Kongress
Liebe Kolleginnen und Kollegen, lie...
ORALIA medical GmbH
Schneckenburgstraße 11
78467 Konstanz
Deutschland
Tel: +49 7531 28403-0
Fax: +49 7531 28403-10
E-Mail: info@oralia.com
COPYRIGHT 2024 | ORALIA MEDICAL GMBH
